ÁGUA: PROPRIEDADES E IMPORTÂNCIA PARA OS ORGANISMOS
Maximiliano Mendes
Sem água a vida como conhecemos não poderia existir. Essa
molécula é tão importante que só um dia de falta d’água na vizinhança é capaz
de tirar muita gente do sério: a nossa hidratação e a nossa higiene podem ficar
comprometidas e pior ainda é saber que há conflitos no oriente médio e na Ásia central
pelo controle de fontes de água. E por
que a água é tão essencial? Por conta das suas propriedades físico-químicas (cor, ponto de fusão, opacidade, calor de combustão, viscosidade, pH e etc). Essas são as propriedades que nos permitem identificar e saber mais sobre a natureza da substância. Vejamos mais sobre ela:
Cerca de 70 % da superfície do planeta é coberta por água e
acredita-se que a vida tenha surgido no ambiente aquático. Isso contribui para
que ela seja uma molécula tão essencial para os organismos até hoje. A maior
parte da massa de um ser vivo é constituída de água, de 70 – 80 % (o percentual
pode variar de acordo com o tipo de tecido, sendo de aproximadamente 20 % no
tecido ósseo e por volta de 85 % para o tecido nervoso cerebral). Além disso, as
reações metabólicas ocorrem em meio aquoso, pois a água é um solvente
(comentaremos mais sobre isso adiante).
A fórmula molecular da água é H2O e sua estrutura
pode ser vista na figura abaixo:
Vemos que a molécula de água não é linear, como o CO2, ela é angular e o átomo de oxigênio é mais eletronegativo que o de
hidrogênio, então, na molécula de água ele atrai os elétrons compartilhados nas
ligações covalentes com maior intensidade, de forma que fica com uma densidade
eletrônica maior e carga parcial negativa (δ-), visto que os
elétrons têm carga negativa. Ao mesmo tempo, por terem seus elétrons atraídos
pelo oxigênio, os hidrogênios ficam com carga parcial positiva (δ+)
(é como se a tendência fosse eles perderem cargas negativas). Por conta disso,
a molécula de água é polar: têm um polo (região) negativo e um polo positivo, resultantes da distribuição eletrônica desigual,
como se pode ver na figura acima. Lembre-se de que nas ligações covalentes os elétrons são compartilhados e não doados ou recebidos como nas ligações iônicas, por isso as cargas são parciais.
Em decorrência de sua polaridade e estrutura, a molécula de
água pode formar ligações de hidrogênio entre si e com outras moléculas
polares. A ligação de hidrogênio é uma interação na qual um átomo bastante
eletronegativo, com carga parcial negativa, atrai para si um hidrogênio com carga parcial positiva de uma
molécula vizinha. Cada molécula de água pode formar até quatro ligações de
hidrogênio: duas para cada átomo de hidrogênio (δ+) e duas para cada
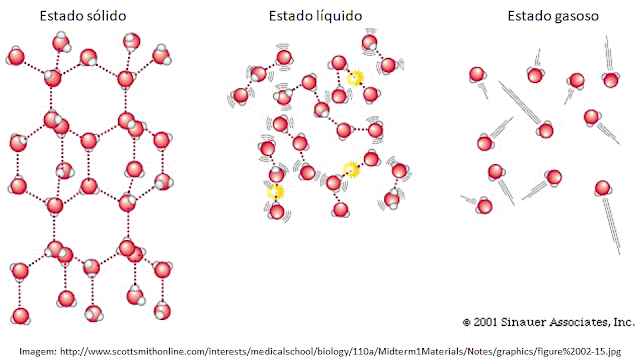
par de elétrons livres do oxigênio (δ-). No Estado sólido as
moléculas de água estão dispostas de modo que formam quatro ligações de
hidrogênio umas com as outras e disso decorre que ficam mais afastadas. Assim,
a água no estado sólido é menos densa que a água no estado líquido, por isso o
gelo boia na água.
Graças às ligações de hidrogênio, as moléculas de água
tendem a se manter unidas, coesas, e podem formar uma “película” na superfície
em contato com o ar, por isso alguns
insetos conseguem andar na superfície da água sem afundar, pois a força peso
que exercem sobre a superfície da água não é o bastante para romper essa
película (note que esses insetos não estão boiando sobre a superfície da
água!). Acredita-se que o
transporte de seiva bruta nas plantas só é possível por conta das forças de coesão,
de modo que podem, por capilaridade, ascender no xilema.
Ainda devido às suas propriedades físico-químicas, a água
pode atuar como solvente. Um solvente é uma substância que atua separando
agregados ou cristais de outras substâncias. Ao conjunto solvente mais substância ou composto iônico dissolvido damos o nome de solução. Às substâncias ou íons dissolvidos no solvente, ou seja, em solução, damos o nome de solutos. Por exemplo, a água pode dissolver
um cristal de sal de cozinha (NaCl) ao interagir e separar os íons componentes,
o Na+, que interage com o oxigênio de carga parcial negativa, e o Cl-,
que interage com os hidrogênios de carga parcial positiva.
As substâncias podem ser classificadas em dois tipos, de
acordo com sua afinidade pela molécula de água:
- Hidrofílicas: são moléculas polares, têm afinidade pela água e podem ser dissolvidas em água. Ex: os glicídios.
- Hidrofóbicas: são moléculas apolares, não têm afinidade pela água e não se dissolvem na água. Os principais exemplos são os lipídios.
A água também está envolvida em diversas reações químicas
que ocorrem dentro das células, sendo basicamente:
- Desidratação: a água é produto da reação. Exemplo: A + B --> C + H2O
- Hidrólise: a água é reagente na reação. Exemplo: D + H2O --> E + F
Outra função importante da água, que também se deve às suas
propriedades físico-químicas, é a de moderadora da temperatura do organismo:
ela previne variações bruscas de temperatura. Os motivos pelos quais ela é
capaz de atuar dessa forma são:
- Calor específico elevado: É difícil esquentar ou esfriar a água.
- Calor latente de vaporização elevado: Ela “rouba” bastante calor quando evapora, pois para isso é preciso romper as ligações de hidrogênio. Graças a isso pode resfriar o organismo e evitar o superaquecimento.
- Calor latente de fusão elevado: A água tem de liberar muito calor para congelar, ou seja, não congela facilmente.
Atenção para as definições:
- Calor específico: quantidade de calor que um grama de uma substância deve absorver para elevar sua temperatura em 1° C, sem que haja mudança de estado físico.
- Calor latente de vaporização: quantidade de calor absorvida durante a vaporização de uma substância em seu ponto de ebulição.
- Calor latente de fusão: quantidade de calor necessária para transformar um grama de uma substância no estado sólido para o estado liquido, na temperatura de fusão.
Referências:
Amabis & Martho. Biologia das Células. Moderna. 2010.
Campbell,
Reece et al. Biologia. 8ª ed. Artmed. 2010.
http://en.wikipedia.org/wiki/Animal_locomotion_on_the_water_surface
http://en.wikipedia.org/wiki/Water_conflict
http://apod.nasa.gov/apod/ap120515.html
http://www.iun.edu/~cpanhd/C101webnotes/matter-and-energy/properties.html
Gostou do material? Achou útil? Quer me ajudar? Clique nos anúncios e no G+1.
http://www.iun.edu/~cpanhd/C101webnotes/matter-and-energy/properties.html
Gostou do material? Achou útil? Quer me ajudar? Clique nos anúncios e no G+1.