OS AMINOÁCIDOS, AS PROTEÍNAS E AS
ENZIMAS PROTEICAS
Se pensarmos na célula como uma
fábrica, capaz de produzir uma variedade enorme de itens, as principais
(nano)máquinas das quais a fábrica celular dispõe são as proteínas. Essas
máquinas podem, dentre outras ações, construir, quebrar, transportar, modificar
e sustentar as moléculas e os componentes celulares.
As proteínas são moléculas constituídas
de uma cadeia linear de aminoácidos
unidos por ligações peptídicas,
responsáveis por executar diversas funções dentro das células, mais notadamente
atuando como enzimas, substâncias
que catalisam reações metabólicas aumentando grandemente as suas velocidades.
Moléculas grandes
(macromoléculas) construídas a partir da ligação de várias subunidades
moleculares do mesmo tipo (nesse caso, aminoácidos), são chamadas polímeros. O termo cadeia é utilizado para se referir a uma molécula constituída de
vários componentes ligados em sequência, que podem ser tanto moléculas quanto
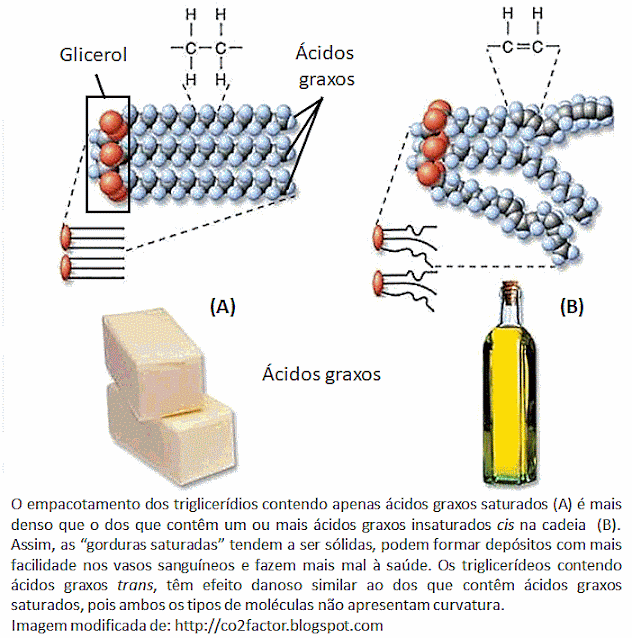
átomos. Por exemplo, os ácidos graxos têm uma cadeia de átomos de carbono
ligados em sequência, já as proteínas são polímeros ou cadeias de aminoácidos
ligados em sequência e os polissacarídeos são polímeros ou cadeias de unidades
glicídicas ligadas.
As proteínas podem ser formadas
por 20 tipos distintos de aminoácidos e cada um deles é uma molécula
consistindo da seguinte estrutura: Um carbono chamado α ao qual se ligam um
átomo de hidrogênio, um grupo amina, um grupo ácido carboxílico (daí o nome
aminoácido) e, também, um radical ou cadeia lateral (R), que varia entre os aminoácidos.
Além de serem componentes das
proteínas, os aminoácidos também podem exercer outras funções, como as de
neurotransmissores ou então serem precursores na síntese de outras moléculas
biológicas importantes.
Nas proteínas os aminoácidos são
unidos entre si por ligações peptídicas,
nas quais o grupo amina de um deles se liga ao grupo carboxila do próximo
(sendo ambos os grupos ligados ao C-α!) havendo a produção de uma molécula de água, ou seja, a
formação de uma ligação peptídica é uma síntese por desidratação. Moléculas consistindo de aminoácidos unidos por
ligações peptídicas são denominadas peptídios.
As proteínas, devido ao fato de que geralmente consistem de vários aminoácidos, são também chamadas de polipeptídios. (Peptídeo: 2 - 49 aminoácidos. Proteína ou polipeptídeo: acima de 50 aminoácidos).
De forma geral, as duas formas
básicas de se obter aminoácidos são através da ingestão via alimentação ou a
síntese dentro das próprias células. É importante destacar que geralmente os
organismos não são capazes de sintetizar todos os 20 tipos de aminoácidos que
constituem as suas proteínas, sendo assim, podemos classificar os aminoácidos em
dois tipos para uma determinada espécie:
A. Aminoácidos não
essenciais: são os que podem ser sintetizados pelas próprias células do
organismo, sendo assim, não necessariamente precisam ser obtidos via alimentação. Esse também podem ser chamados de aminoácidos naturais.
B. Aminoácidos essenciais:
são aqueles que o organismo não é capaz de sintetizar, então, têm de ser
obtidos via alimentação. Para a espécie humana são oito aminoácidos: valina,
leucina, treonina, fenilalanina, lisina, isoleucina, triptofano e metionina.
É importante lembrar que um
aminoácido essencial para uma espécie não necessariamente o é para outra que é
capaz de sintetizá-lo e vice-versa. E também é interessante saber que a
combinação arroz com feijão pode nos fornecer todos os aminoácidos essenciais (e tem a vantagem de ser uma combinação de baixo custo).
No que diz respeito à arquitetura
das proteínas, identificamos os seguintes níveis estruturais:
1. Estrutura primária: é a sequência dos aminoácidos que constituem
a proteína.
2. Estrutura secundária: consiste em um primeiro nível de
enrolamento helicoidal da proteína, graças às interações geralmente do tipo
ligações de hidrogênio entre os aminoácidos que se localizam próximos uns dos outros na sequência, formando estruturas conhecidas
como α-hélices (nada a ver com o C-α!) e folhas-β.
3. Estrutura terciária: forma
tridimensional que a molécula de proteína adquire ao se dobrar sobre si
mesma graças às interações entre os seus aminoácidos. Neste caso, os aminoácidos podem estar localizados longe um do outro na sequência, mas podem interagir pois, devido ao dobramento da proteína, podem ser posicionados proximamente. Esta estrutura é determinada
pela sequência de aminoácidos. A estrutura terciária determina a função da proteína.
4. Estrutura quaternária: consiste de duas ou mais cadeias
polipeptídicas (proteínas) unidas por ligações não covalentes.
Desnaturação é o nome que se dá à perda da estrutura terciária das
proteínas graças ao rompimento das interações entre os aminoácidos, como as
ligações de hidrogênio. Na medida em que desnatura, a proteína se "desenrola". Uma proteína desnaturada perde a
função.
Como exemplos de fatores capazes
de desnaturar uma proteína temos: altas temperaturas, altas concentrações de
sais, grandes variações na acidez ou alcalinidade do meio, agitação e etc. O
aquecimento de um ovo desnatura a albumina, proteína presente na clara. A
desnaturação promove o entrelaçamento entre as moléculas de albumina, a chamada coagulação, que por
sua vez promove o endurecimento da clara. O aumento da acidez no leite,
que pode ser devido à atuação de micro-organismos, também promove a desnaturação
e o emaranhamento das proteínas do leite, fazendo com que ele coalhe.
As principais funções das
proteínas são atuarem como:
A. Enzimas, catalisando
as reações metabólicas para que ocorram em velocidades rápidas o suficiente
para sustentar a vida. OBS: Nem todas as proteínas são enzimas e nem todas as enzimas são proteínas (algumas moléculas de RNA também podem exibir atividade enzimática).
B. Anticorpos ou
imunoglobulinas, proteínas envolvidas na defesa imune do organismo.
C. Proteínas contráteis,
responsáveis pelos movimentos celulares, como a contração das células
musculares.
D. Hormônios,
substâncias mensageiras que atuam no controle do funcionamento do organismo.
Nem todos os hormônios são proteínas, por exemplo, os hormônios esteroides têm natureza lipídica.
E. Proteínas de reserva
energética, como a albumina da clara dos ovos.
F. Proteínas de transporte,
como a hemoglobina, que transporta o O2.
AS ENZIMAS PROTEICAS
Apesar de nem todas as proteínas
serem enzimas e nem todas as enzimas serem proteínas, uma das funções
principais das proteínas é a de atuarem como enzimas e aumentarem bastante a velocidade das reações metabólicas ao
catalisarem-nas (as enzimas fazem isso ao diminuírem a energia de ativação para que uma reação ocorra). De forma geral, para manter a vida, essas reações devem
ocorrer numa velocidade bastante superior àquela na qual ocorreriam caso não
fossem catalisadas pelas enzimas, sendo que
a diferença pode ser de milissegundos com a enzima, e bilhões de anos sem! Inclusive, podemos considerar que todas as reações metabólicas são catalisadas por enzimas! (Lembre-se: alguns RNAs também podem atuar como enzimas, chamadas ribozimas, mas aqui nós trataremos apenas das enzimas proteicas).
As enzimas são capazes de
catalisar as reações metabólicas, pois graças à sua estrutura tridimensional/terciária,
possuem locais chamados centros ativos, ou sítios
catalíticos, que consistem basicamente em “encaixes”, onde se ligarão sustâncias específicas chamadas substratos, que são os reagentes em uma reação metabólica. Note
que o centro ativo das enzimas geralmente é específico: somente um tipo de substrato tem o formato complementar a ele, assim, normalmente só os substratos podem se ligar aos sítios ativos das enzimas e não várias
outras moléculas distintas!
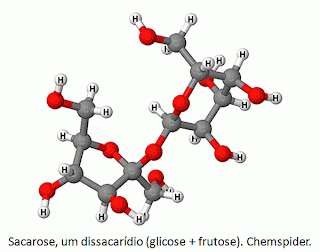
Como exemplo de reação catalisada
por uma enzima, pode-se citar a quebra do substrato sacarose em seus dois monossacarídeos
constituintes, uma molécula de glicose e uma de frutose pela enzima chamada
sacarase.
Observe na figura que o sítio
ativo da sacarase apresenta formato complementar
ao da sacarose. Sendo assim, o substrato se liga à enzima e a reação procede em
uma velocidade muito maior se comparada à mesma reação não catalisada pela
enzima. Note também que a enzima não sofreu modificações químicas e ao término
da reação pode se ligar a outra molécula de sacarose e catalisar mais uma
reação de quebra.
Várias enzimas consistem apenas
da cadeia polipeptídica, todavia, outras requerem a ligação dos chamados cofatores para que possam funcionar
(tornarem-se ativas) exercendo o seu papel de catalisadoras biológicas. O cofator
é a porção não proteica da enzima. Nos casos em que há a necessidade de cofatores,
a parte proteica da enzima, inativa, é chamada apoenzima, e ao conjunto ativo, da
apoenzima mais o cofator, dá-se o nome holoenzima.
De forma geral, os cofatores mais
comuns são:
A. Íons metálicos, como
o Cu+2, Mg+2, Zn+2, Fe+2, Fe+3
e etc.
B. Vitaminas hidrossolúveis. Neste
caso, quando o cofator é outra molécula orgânica, dá-se a ele o nome de coenzima.
Além dos cofatores e substratos,
outras substâncias podem se ligar às enzimas e inativá-las, ou seja, impedi-las
de realizar suas funções. Essas substâncias são chamadas de inibidores e podem se ligar ao sítio catalítico da enzima, ou em outros locais, de forma que alteram a
conformação espacial (formato tridimensional) do sítio ativo, fazendo com que
ele perca a complementaridade que deve ter com o substrato:
Os inibidores podem inativar as
enzimas de forma reversível ou irreversível:
A. Inibição reversível:
a enzima pode voltar a funcionar, pois o inibidor pode se desligar/dissociar dela.
B. Inibição irreversível:
admite-se que a enzima não pode mais voltar a funcionar, pois a ligação do
inibidor a ela é muito forte, então ele não mais se dissocia dela.
Várias drogas e venenos são
inibidores irreversíveis de enzimas, alguns exemplos:
1. Os íons cianeto – CN-, ligam-se de forma irreversível à
enzima citocromo oxidase, que faz parte da cadeia de transporte de elétrons,
uma das etapas do processo de respiração celular. O resultado é que a célula
pode perder a capacidade de executar o processo de respiração celular e acaba
morrendo.
2. O antibiótico penicilina se liga de forma
irreversível à transpeptidase bacteriana. Com essa enzima inativada, as
bactérias perdem a capacidade de sintetizar as suas paredes celulares, acabam
lisando e morrendo.
3. O medicamento aspirina se liga à ciclo-oxigenase,
impedindo a síntese de prostaglandinas. O resultado é a inibição do processo
inflamatório.
Além dos inibidores, outros
fatores podem afetar a atividade das enzimas e, com isso, as velocidades das reações químicas. Basicamente, eles são os mesmos fatores
capazes de desnaturar uma proteína (lembre-se de que estamos tratando das
enzimas proteicas). Como exemplos:
1. Temperatura: o aumento da temperatura pode elevar a velocidade
da reação catalisada até certo ponto, chamado de temperatura ótima para a ação
da enzima, graças ao fato de que aumenta o grau de agitação das moléculas e, com isso, o número de colisões eficazes entre elas, resultando em reações
químicas. Porém, passando desse ponto, o aumento da temperatura começa a desnaturar a enzima, sendo que a perda
da estrutura tridimensional faz com que ela perca a sua atividade catalítica.
2. pH: meios muito ácidos ou muito alcalinos também podem afetar a
atividade enzimática ao desnaturá-la. De forma geral, as enzimas atuam em faixas de pH, o chamado pH ótimo, de
acordo com a localização celular ou o órgão. Fora da faixa de pH ótimo, a
atividade da enzima decai drasticamente por conta dessa desnaturação. Por exemplo, enzimas como a pepsina,
presente no suco gástrico, atuam em meios ácidos, ao passo que as enzimas dos
sucos pancreático e entérico atuam em meios alcalinos.
Enzimas e doenças
Pode acontecer de o organismo ser
incapaz de produzir uma enzima funcional, ou então nem mesmo ser capaz de
produzi-la. Tendo em vista o fato de serem tão importantes para o organismo é
de se esperar que o mau funcionamento de uma enzima, ou mesmo a sua ausência,
possam acarretar em doenças graves. Dois exemplos:
1. Fenilcetonúria: doença causada pela incapacidade do organismo em
produzir a enzima fenilananina-4-monoxigenase, que converte o aminoácido
fenilalanina em tirosina (outro aminoácido). Como resultado da falta da enzima,
ocorre o acúmulo da fenilalanina, que inclusive pode causar danos aos
neurônios. Esse é um dos motivos pelos quais os portadores da doença, os
fenilcetonúricos, devem ingerir quantidades mínimas desse aminoácido. A doença pode
ser detectada ainda cedo com a realização do conhecido teste do pezinho, que
consiste em coletar gotas de sangue do pé do recém-nascido para análises.
2. Doença de Fabry: causada pela deficiência (ou ausência) da
enzima alfa-galactosidase-A, importante no metabolismo de lipídios. A falta da
enzima faz com que um glicolipídio chamado globotriaosilceramida se acumule no
organismo, inclusive nos vasos sanguíneos, o que por sua vez pode acarretar em
danos ao coração, rins e cérebro.
Veja também:
http://ed.ted.com/lessons/what-triggers-a-chemical-reaction-kareem-jarrah
(Tem legendas em língua portuguesa).
Referências:
ALBERTS, B. et al. Molecular Biology
of the Cell. 4th ed. Garland. 2002.
AMABIS & MARTHO. Biologia
das Células. Moderna. 2004.
CAMPBEL & REECE. Biology. 7th Ed. Benjamin-Cummings.
2005.
KOOLMAN & ROEHM. Color Atlas of
Biochemistry. 2nd Ed. Thieme. 2005.
LEHNINGER, et al. Principles of Biochemistry.
4th Ed. WH Freeman. 2004.
LODISH, H. et al. Molecular Cell
Biology. 5th ed. WH Freeman. 2003.
STRYER, L. et al. Biochemistry. 4th
ed. WH Freeman. 2002.